Grundlæggende forudsætninger for at teste kvægbesætningen for Salmonella Dublin
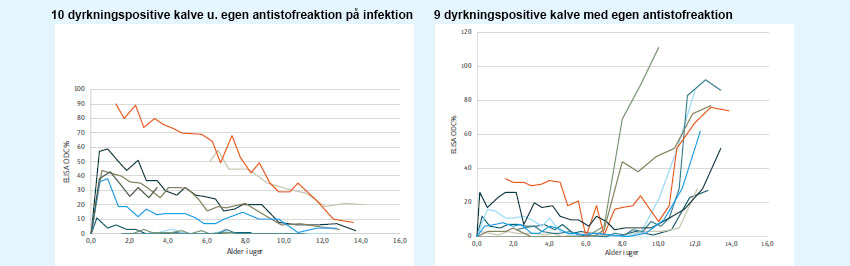
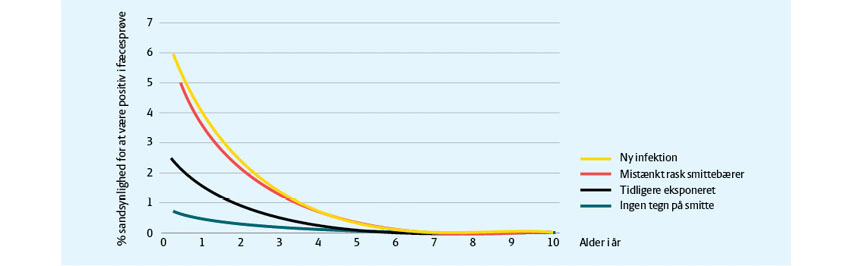
Besætninger med megen smittespredning vil have en blanding af dyr med høje og lave antistofmålinger. Dyrene vil befinde sig på forskellige stadier af antistofudviklingen, og man rammer ned et mere eller mindre tilfældigt sted i deres forløb, når man udtager en stikprøve.
Nogle dyr vil være nysmittede og ikke have udviklet antistoffer endnu. Andre gennemgår en infektion og begynder at reagere, men ligger måske ikke højt endnu. Og nogle dyr vil have overstået infektionen og har renset sig, men har stadig højt niveau af antistoffer i 3-9 måneder. Der er stor variation fra dyr til dyr.
Endelig kan nogle få dyr være blevet vedvarende smittebærere (ofte kaldet ’raske smittebærere’, fordi de ikke udviser kliniske tegn på sygdom, selvom de er smittede). Sidstnævnte vil oftest fortsat have høje antistofmålinger (over ca. 80 ODC%) over længere tid.
Langt de fleste besætninger med testpositive kalve (3-6 måneder gamle) har aktiv smittespredning. Ikke bare hos kalvene, men også længere oppe i systemet. Det kan som regel ikke betale sig at teste ældre dyr i besætningen, før kalvene kan holdes fri for smitte. Ellers bliver der ved med at komme ny smitte nede fra de unge dyregrupper.
Start med at få staldhygiejne og belægning optimeret i kvægstalden
Det betyder også, at man bliver nødt til at starte med at få optimeret hygiejnen og nedbringe kontakten
mellem smittefarlige og modtagelige dyr. Belægningsgraden skal ofte reduceres, eller der skal arbejdes på at skabe luft i systemet. Dette kan kræve, at der tages nye arealer i brug eller indkøbes nye bokse, eller benyttes en tom stald på en anden ejendom i en periode.
Plads, luft og tørt underlag (velstrøede bokse) gør det sværere for salmonella at overleve og spredes. Kalvene skal beskyttes effektivt mod smitte. Både under og efter kælvningen samt i de vogne/bokse/hytter, kalvene kommer ind i som spæde (og glem ikke rene kalvekuvøser og transportvogne, der bruges til at transportere kalvene mellem kælvningsareal og kalveboks/hytte).
Det er en vigtig forudsætning for succes, at hullerne i smittevejene lukkes eller i hvert fald mindskes. Ellers vil man blive ved med at få testpositive kalve, og så kommer man ikke videre.
Udtag tankmælk til test for Salmonella Dublin
Hvis besætningen ikke allerede får udtaget tankmælk til test hver måned, anbefales det at igangsætte dette, så udviklingen bedre kan følges. Når tankmælken begynder at falde, er det tid til at gå mere aktivt til værks med udpegning af dyr, der konstant ligger højt, samtidig med at der holdes skarpt øje med, at der ikke igen spredes smitte hos kalve og kvier, der skal kælve og lige har kælvet.
Hygiejnen skal fastholdes på et højt niveau nu, og test af kalve, tankmælk og udpegning af smittebærere bør fortsættes, indtil besætningen har været i Niveau 1 i 1 år. Tankmælken bør fortsættes på månedlige målinger i 3 år, efter Niveau 1 er opnået og tjekkes for udsving, der kan være tegn på, at noget rører på sig igen. Det frarådes at stoppe bekæmpelsesindsatsen, før tankmælken ligger stabilt under 10 ODC%.
De gode hygiejne- og forebyggende tiltag bør fortsættes. Det vil være dumt at slække på smittebeskyttelsen, når man har set, at det modvirker smitte. Husk, at indsatsen ikke kun virker forebyggende på salmonella, men også mange andre infektioner. Besætningen vil løbende være i risiko for at optage ny smitte fra miljøet og andre besætninger, og de effektive tiltag, man har fået indført, modvirker, at smitten vil få fat og sprede sig, selv hvis uheldet skulle være ude, og salmonellabakterier kommer ind i besætningen igen.
Det skal bemærkes, at der kan være flere forskellige versioner eller kombinationer af ovenstående teststrategi, der er relevante. Det vil afhænge af den enkelte besætnings struktur, størrelse og smittepres i forskellige staldafsnit, samt hvilke muligheder der findes for at sektionere og sætte mistænkte smittebærere ud.