
Yversundhed hos malkekøer
Mastitis - eller på dansk yverbetændelse - er den mest udbredte sygdom hos malkekøer. På denne temaside finder du nyheder og viden om, hvordan du forbedrer yversundheden i din besætning.

Mastitis - eller på dansk yverbetændelse - er den mest udbredte sygdom hos malkekøer. På denne temaside finder du nyheder og viden om, hvordan du forbedrer yversundheden i din besætning.

Kvæg
Vinterkulden gør huden på køernes patter sårbar og øger risikoen for patteskader. Gå i gang med at forebygge skader allerede nu. Brug bl.a. tørre klude, hurtigttørrende pattedyp og evt. afskærmning ved returgangen.
Kvæg
Rene køer er en vigtig forudsætning for at undgå stigning i celletallet om sommeren. Sæt derfor allerede nu de nødvendige tiltag i gang, som sikrer rene køer. Det gavner hele året rundt.
Kvæg
Malkeklude er en vigtig brik i god yversundhed hos køer. Men slidte klude og for lav vasketemperatur er nogle af de parametre, der hurtigt forvandler god patteaftørring til effektiv smittespredning.
Kvæg
Dårlige eller forkerte malkerutiner går både gå ud over dyrevelfærden, øger risikoen for yverbetændelse og kan reducere ydelsen. Der er med andre ord rigtig god grund til at sørge for gode rutiner i malkestalden, og sikre at alle malkere kender rutinerne.

Kvæg, Økonomi og ledelse
Får du det højst mulige kvalitetstillæg for din mælk? Hvis ikke, så tag en snak med SEGES Mælkekvalitet. Sammen med dig kigger vi på alle muligheder for at forbedre både mælkekvalitet, yversundhed og bundlinje.
Kvæg
Optimalt management omkring goldning er afgørende for at give koen det bedst mulige udgangspunkt for den nye laktation. Her får du anbefalinger til gode rutiner og procedurer før, under og efter goldning.
Kvæg
Et veterinært speciale har identificeret 4 grupper af holdninger til, hvordan kvæglandmænd opfatter antibiotikaanvendelse. Det giver et indblik i, hvad der motiverer forskellige landmænd til at bruge eller ikke bruge antibiotika.
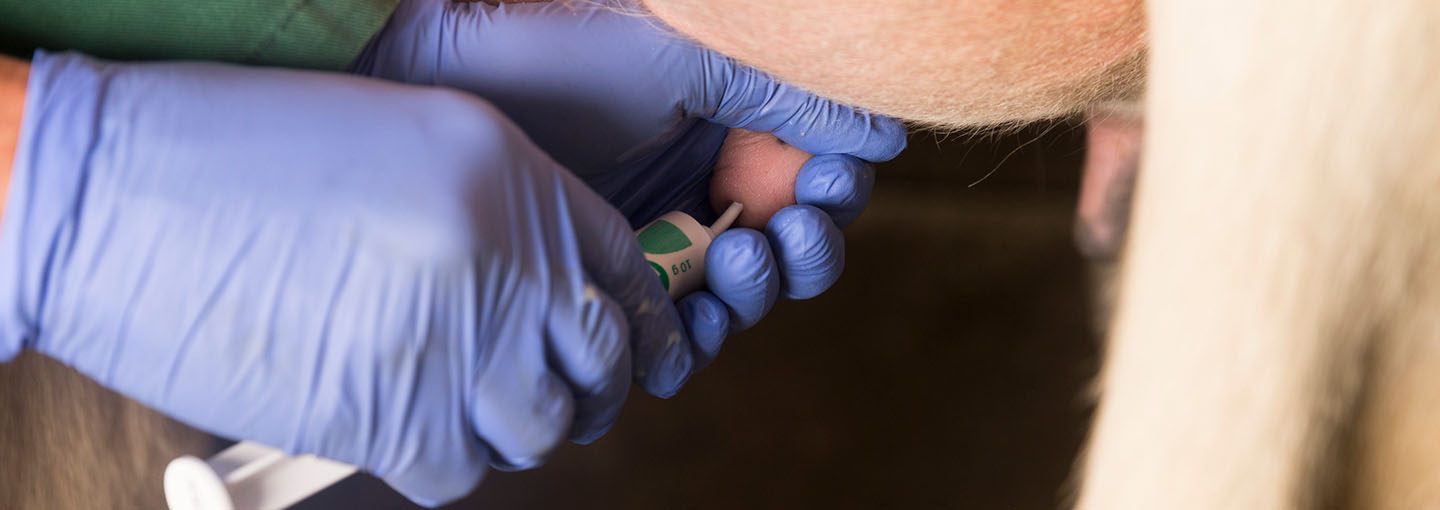
Kvæg
Følg 3 anbefalinger og få bugt med flest mulige tilfælde af mastitis med mindst mulig brug af antibiotika.
Kvæg
Streptococcus uberis er årsag til en stor andel af yverinfektionerne i Danmark. Her får du overblik over symptomer, forebyggelse og behandling af yverbetændelse forårsaget af Streptococcus Uberis.
Kvæg
Et studie har vist, at det er muligt at reducere både antibiotikaforbrug for forekomsten af mastitis i kvægbesætninger. Strategierne betyder, at de danske landmænd kan balancere mellem antibiotikaforbrug og mastitis.

Kvæg
Foreløbige resultater viser, at behandlingseffekten over for uberis-yverbetændelse hos malkekøer er den samme, uanset om man supplerer tuber i yveret med injektion i kroppen eller ej. Det åbner en effektiv mulighed for at reducere antibiotikaforbruget hos kvæg.
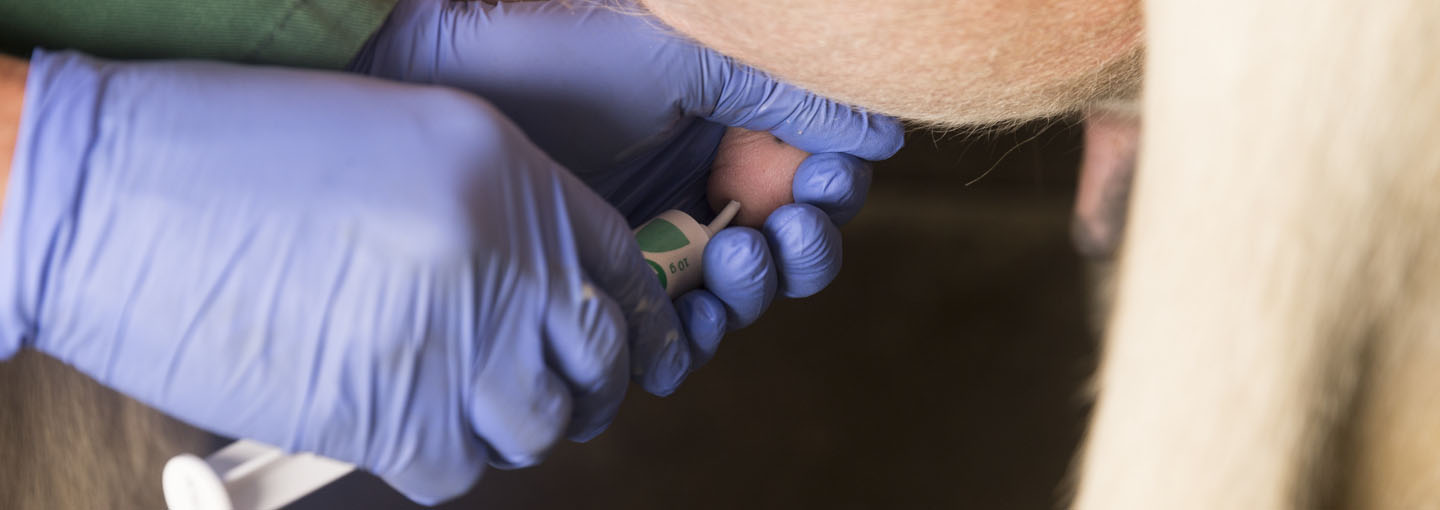
Kvæg
Behandling af yverbetændelse hos kvæg med andet end simple penicilliner kræver resistensbestemmelse. Veterinært laboratorium, Kjellerup er akkrediteret til at foretage både resistensbestemmelsen og diagnostik.

Kvæg
Fra 1. juni 2021 er det blevet et krav, at der skal tages en mælkeprøve af alle yverbetændelser, der bliver behandlet med antibiotika. Krav om mælkeprøver ved goldning bliver lempet.

Kvæg
I USA har de et indeks for køernes overgangsperiode, Transition Cow Indeks, der viser, hvor godt køerne kommer igennem tiden som goldkøer og nykælvere. Se også listen over, hvilke forhold i køernes overgangsperiode, der påvirker mælkeydelsen mest.
Kvæg
Optimalt management omkring goldning er afgørende for at give koen det bedst mulige udgangspunkt for den nye laktation. Her får du anbefalinger til gode rutiner og procedurer før, under og efter goldning.
Kvæg
Man kan undgå stort set alle produktionssygdomme, fx mælkefeber, børbetændelse, ketose, yverbetændelse og hornrelaterede klovlidelser, hvis køerne kommer godt igennem overgangsperioden fra en laktation til den næste.
Kvæg
Med Danske anbefalinger for management af goldko får du 21 tips og kontrolpunkter, når du optimerer køernes overgang fra en laktation til den næste.


Chefkonsulent, Specialdyrlæge i Yversundhed & Mælkekvalitet, MBA & Ph.D
SEGES Innovation